Hypertrofi i teori – Følgeartikel til Stærkt Akavet ep. 3
Indholdsfortegnelse
Den følgende artikel har til formål at give en basal gennemgang af hvordan muskler er opbygget, samt hvordan og hvorfor de vokser (hypertrofi). Denne artikel har IKKE til formål at gå i dybden med hvert enkelt emne, da det ville kræve udarbejdelsen af en lærebog. Den skal altså ses som en hurtig (relativt til kompleksiteten af emnet) gennemgang af emnet. Har du selv lyst til at tage en dybere spadestik i litteraturen omkring muskelvækst, vil jeg henvise dig til referencelisten, men især de følgende reviews (10–12,14,16,21,22). Hør det medfølgende podcast episode her:
Hvordan er muskler opbygget?
Muskelanatomi
Følgende afsnit er baseret på følgende reviews (2,8–11,13,16,22).
Lad os starte på det makroskopiske niveau; det vi kan se uden et forstørrelsesglas. En muskel er i alt sin enkelthed et stort bundt af individuelle muskelfibre, også kaldet myofibre, som ligger enten parallelt til eller i forlængelse af hinanden. Dette store bundt (den hele muskel) er omgivet af et bindevævslag, fascie, kaldet epimysium, som sammen med de andre bindevævslag overgår til senevæv i enden af musklen via det myotendinøse knudepunkt, før den endeligt finder sit hæfte på en knogle. Det er igennem denne tilhæftning mellem to knogler, at musklen, igennem sammentrækning/kontraktion, skaber bevægelse.
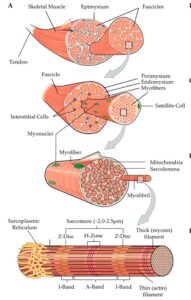 Musklen består dog ikke blot af en masse fritlæggende myofibre. Disse myofibre er nemlig organiseret på en speciel måde i bundter af bundter af fibre. Bundterne af flere bundter er kaldt fascikler og er omgivet af bindevævslaget perimysium, hvor de enkelte bundter af myofibre inde i fasciklen er adskilt af bindevævslaget endomysium.
Musklen består dog ikke blot af en masse fritlæggende myofibre. Disse myofibre er nemlig organiseret på en speciel måde i bundter af bundter af fibre. Bundterne af flere bundter er kaldt fascikler og er omgivet af bindevævslaget perimysium, hvor de enkelte bundter af myofibre inde i fasciklen er adskilt af bindevævslaget endomysium.
Selve myofiberen, som er omgivet af cellemembranen, sarkolemma, består af 500 til 10.000 myofibriller, som endnu en gang består af 1.000 til 2.000.000 sarkomerer, der ligger i forlængelse af hinanden. Sarkomererne er i deres ender afgrænset af Z-diskene og består bl.a. af de overlappende proteiner aktin, myosin og titin, som også kaldes myofilamenter. De er ansvarlige for musklens evne til at trække sig sammen og producere kraft, igennem det, der kaldes tværbrosdannelse. Z-disken afgrænser som sagt sarkomerens sider. Det er også her, hvor sarkomeren gennem diverse proteiner hæfter til Z-disken på andre sarkomerer, samt sarkolemma. Ligeledes er det her, de store strukturelle proteiner, titin, nebulin og obscurin, hæfter, hvilket gør Z-diskene uundværlige, når det kommer til kraftoverførsel.
Sarkomererne er koblet til hinanden og sarkolemma gennem nogle proteiner kaldt filamin-C og costamerer, som begge er involveret i mekanotransduktion (overførslen af mekanisk spænding til kemiske signaler) via proteinerne integriner.
Proteiner tager omkring 80% af pladsen indenfor sarkolemma, hvoraf 70-80% af disse proteiner er aktin og myosin, mens den resterende plads er optaget af sarkoplasma og resten af celleorganerne. Disse inkluderer bl.a. cellekernerne og ribosomerne, som bl.a. er ansvarlige for nydannelsen af proteiner, mitokondrierne, der er ansvarlige for aerob energiproduktionen, og sarkoplasmatisk retikulum, som er involveret i aktiveringen af muskelsammentrækningen gennem lagringen, frigørelsen og optagelsen af calcium-ioner. Indlejret i sarkolemma findes desuden noget, der hedder satellitceller, som er musklernes stamceller. Når aktiveret af signalstoffer kaldet myogeniske faktorer, flyttes satellitcellerne ind i sarkoplasma og omdannes til nye cellekerner, hvilket derved øger musklens kapacitet for nydannelsen af nye proteiner.
Aktin udspringer fra Z-disken og rækker ind i sarkomeren, hvor den fletter sammen med myosin, som udgår fra sarkomerens midte. Aktin og myosin står ifølge the sliding filament theory for muskelsammentrækningerne ved at binde sig til hinanden, hvorefter myosin skaber et træk i aktin via myosinhovedet. Igennem tilstrækkeligt af disse ”træk” bringes Z-diskene tættere på hinanden, og vi har en forkortet sarkomer og derfor også forkortet muskel.
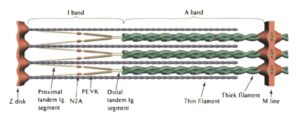
Titin er et stort protein, faktisk det største kendte protein, der rækker halvdelen af sarkomerens længde og har til funktion at stabilisere myosinfilamentet, diktere sarkomerens passive spænding og har sandsynligvis en aktiv rolle i muskelkontraktion. Titin er delt ind i flere regioner, hvor jeg vil primært vil fokusere på I-bånds-regionen. Denne del af titin er den molekylære fjeder, som er relevant for musklens passive spænding, signalering og aktiv muskelkontraktion. Denne region er delt ind i to segmenter: tandem-Ig-segmentet og PEVK-segmentet. 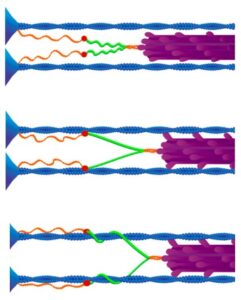 De to segmenter er forenet gennem N2A-regionen. Ig-segmentet udfolder sig ved lave kræfter, mens PEVK-segmentet udfolder sig ved høje kræfter. Nyere forskning viser desuden, at N2A-regionen under tilstedeværelsen af calciumioner ved aktiv muskelsammentrækning hæfter sig til aktinmolekylet og på den måde spiller en mere aktiv rolle i kontraktioner end tidligere troet. Dette er vigtigt, da det er grundlaget for en nyere teori, der hedder the winding filament theory, som fortæller, at når myosin binder og trækker i aktin, så sker der ikke kun et træk i aktin. I denne proces roteres aktinmolekylet også. Da titin via sin N2A-region bindes til aktin, betyder det, at titin under kontraktion snores omkring aktinmolekylet, hvorved musklen bliver bedre i stand til at holde igen, end den ellers ville være, hvis den kun var afhængig i tværbrosdannelsen.
De to segmenter er forenet gennem N2A-regionen. Ig-segmentet udfolder sig ved lave kræfter, mens PEVK-segmentet udfolder sig ved høje kræfter. Nyere forskning viser desuden, at N2A-regionen under tilstedeværelsen af calciumioner ved aktiv muskelsammentrækning hæfter sig til aktinmolekylet og på den måde spiller en mere aktiv rolle i kontraktioner end tidligere troet. Dette er vigtigt, da det er grundlaget for en nyere teori, der hedder the winding filament theory, som fortæller, at når myosin binder og trækker i aktin, så sker der ikke kun et træk i aktin. I denne proces roteres aktinmolekylet også. Da titin via sin N2A-region bindes til aktin, betyder det, at titin under kontraktion snores omkring aktinmolekylet, hvorved musklen bliver bedre i stand til at holde igen, end den ellers ville være, hvis den kun var afhængig i tværbrosdannelsen.
Der findes et utal af andre vigtige proteiner i muskelvæv, hvor bl.a. troponin, tropomyosin, titin og nebulin kan nævnes. Nebulin er et strukturelt protein, mens troponin og tropomysion er vigtige i reguleringen af tværbrocyklussen. At gå mere i dybden hermed er ikke relevant for denne artikel.
Sarkomeren
Tværbrosdannelse (8,13,16,18)
Processen, hvorigennem myofilamenterne er aktiveret, kaldes excitation-contraction coupling (EC-coupling). Efterfulgt af depolariseringen af en nerve, udbreder et aktionspotentiale sig via motorneuronet og er overført til myofiberen ved den motoriske endeplade gennem diffusion af neurotransmitteren acetylkolin. Depolariseringen af myofiberen er så ført videre gennem sarkolemma, som via T-rørene føres til sarkoplasmatisk retikulum, hvorved der frigøres calcium-ioner som, via binding til proteinerne troponin og tropomyosin, frigør bindingsstederne mellem aktin og myosin, hvilket medfører, at myosin kan binde til og trække i aktinfilamentet, resulterende i en sammentrækning af musklen. Herefter spaltes APT i myosinhovedet via ATPase, som resulterer i, at myosinhovedet slipper aktinfilamentet, hvorved en ny tværbro kan dannes. Kraften produceret af sarkomeren kan enten blive overført langs fiberens retning eller lateralt (ud til siden). Hvis det er langs fiberens retning, går kraften fra Z-disk til Z-disk, indtil den til sidst når musklens ende, senevævets start og over til knoglen.
Dette resulterer i en muskelkontraktion, som kan opdeles i isometrisk, koncentrisk og excentrisk. En isometrisk kontraktion involverer kraftproduktion uden bevægelse af et led. En koncentrisk kontraktion er en kontraktion, hvor hver ende af musklen bevæger sig mod midten (”kon” = mod, ”centrisk/centrum” = midtpunktet). Modsat er en excentrisk kontraktion en kontraktion, hvor hver ende af musklen bevæger sig væk fra midten midten (”ex” = ikke, ”centrisk/centrum” = midtpunktet).
Studier, der har fjernet titin, har, udover at observere et næsten komplet tab af passiv spænding i musklen, også observeret op til 50% tab af kraftproduktion, hvilket tyder på, at titin muligvis også spiller en mere aktiv rolle i muskelsammentrækning. Noget tyder på, efter depolarisering af muskelcellen og frigørelsen af calcium-ioner, at spændingen af titin øges – en effekt, der vedbliver lidt tid, selv efter tværbrosdannelserne er brudt. N2A-regionen af titin er påvist at binde til aktin ved tilstedeværelse af calcium-ioner, og under stræk kan den forklare 66% af den energi, der er lagret i musklen, hvilket muligvis kan forklare, hvorfor vi er betragteligt stærkere under excentriske kontraktioner. Da denne binding varer op til 4,7 sekunder efter, at calcium ikke længere er at finde, kan titin muligvis også være med til at forklare en stor del af stretch-shortening-cyklussen og lagringen af elastisk energi. Yderligere tænkes det, at i takt med tværbrodannelsen, så trækkes aktin og myosin ikke blot tættere sammen, men aktin roteres også. Dette medfører, at titin vikles omkring aktin, hvorved musklen ”spændes op”. Dette kan være med til at forklare, hvorfor vi er i stand til at producere højere kræfter under excentriske kontraktioner for mindre energi. Noget som den gamle sliding filament theory ikke kunne forklare.
Længdespændingskurven (8,13,15–18)
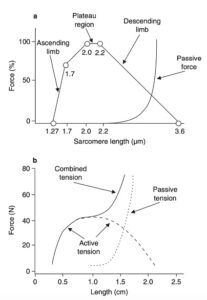 Længdespændingskurven beskriver, at den isometriske kraft, en muskel kan producere, varierer efter musklens længde. Kraftproduktionen er direkte proportionel med antallet af mulige interaktionspunkter mellem aktin og myosin – altså overlappet af aktin og myosin. Ved længder kortere eller længere end ved det optimale overlap vil den mulige isometriske kraftproduktion være reduceret.
Længdespændingskurven beskriver, at den isometriske kraft, en muskel kan producere, varierer efter musklens længde. Kraftproduktionen er direkte proportionel med antallet af mulige interaktionspunkter mellem aktin og myosin – altså overlappet af aktin og myosin. Ved længder kortere eller længere end ved det optimale overlap vil den mulige isometriske kraftproduktion være reduceret.
Det traditionelle længdespændingsforhold kan dog ikke forklare, hvorfor en muskel er i stand til at producere mere kraft ved den samme muskellængde, hvis den først er blevet udsat for strækm eller at muskler hurtigt returnerede til deres hvilelængder efter at være blevet udstrakt uden tilstedeværelse af et aktionspotentiale. Som tidligere nævnt fungerer titin som en molekylær fjeder. Selve den molekylære fjeder kan opdeles i to fjedre, hvor den ene del udfoldes ved stræk af lav kraft (Ig-domænet), og den anden udfoldes ved høje kræfter (PEVK-regionen). Disse dele er forbundet af N2A-regionen. Det er netop denne opbygning, der forklarer den eksponentielle stigning i passiv spænding med stræk. En lille stigning ses med udfoldelse af Ig-domænet, hvorfra spændingen stiger hurtigt i takt med, at strækket bliver større og udfolder PEVK-regionen. 20-60% af den passive spænding i en muskel kan forklares gennem titin, hvor resten nok skal findes i musklens kollagene væv. Under passivt stræk finder strækket primært sted i Ig-segmentet, mens N2A-regionen ved aktivt stræk bindes til aktin, hvilket fastgør Ig-segmentet, hvorfra strækket nu finder sted i den stærkere PEVK-region.
Krafthastighedskurven (1,8,13,15,18)
Krafthastighedsforholdet dikterer, at kontraktionshastigheden mod en konstant kraft varierer som en funktion af muskelkraft, så længe intentionen om en maksimal kontraktion er opfyldt. Med andre ord; jo hurtigere en muskel trækker sig sammen, jo mindre en kraft kan den levere. Dette er dog modsat for excentriske kontraktioner, hvor tungere belastninger resulterer i hurtigere excentriske kontraktioner.
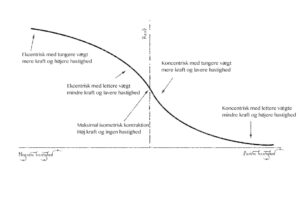 Denne afhænger igen af overlappet mellem aktin og myosin, idet at der ved meget høje hastigheder ikke kan nå at blive dannet tværbrosdannelser over alle mulige interaktionspunkter mellem aktin og myosin, ligesom kraftudviklingen for hver enkel tværbrosdannelse falder med stigende kontraktionshastighed. Dertil er der dog også noget der tyder på, at faldet i koncentrisk kraft har noget at gøre med titin. Under den koncentriske fase vil kinetisk energi oplagres i titin, mens den vikles om aktin. Selvom dette måske kan tænkes at være negativt i den koncentriske fase, betyder det også, at vi excentrisk kan udøve betragteligt større kræfter med minimalt energiomkostning til følge. Netop fordi myosin og aktin-filamenterne primært vil arbejde isometrisk, men den passive spænding i titin udnyttes. In vivo har neuralt drive, lateral kraftforskydning, muskelarkitektur, leddenes vægtstangsarme, intermuskulær koordination osv. også en betydning.
Denne afhænger igen af overlappet mellem aktin og myosin, idet at der ved meget høje hastigheder ikke kan nå at blive dannet tværbrosdannelser over alle mulige interaktionspunkter mellem aktin og myosin, ligesom kraftudviklingen for hver enkel tværbrosdannelse falder med stigende kontraktionshastighed. Dertil er der dog også noget der tyder på, at faldet i koncentrisk kraft har noget at gøre med titin. Under den koncentriske fase vil kinetisk energi oplagres i titin, mens den vikles om aktin. Selvom dette måske kan tænkes at være negativt i den koncentriske fase, betyder det også, at vi excentrisk kan udøve betragteligt større kræfter med minimalt energiomkostning til følge. Netop fordi myosin og aktin-filamenterne primært vil arbejde isometrisk, men den passive spænding i titin udnyttes. In vivo har neuralt drive, lateral kraftforskydning, muskelarkitektur, leddenes vægtstangsarme, intermuskulær koordination osv. også en betydning.
I mange tekstbøger illustreres krafthastighedskurven typisk som en affladet S-kurve. Denne form er særlig tydelig in vitro, hvor isolerede muskelfibre undersøges. In vitro i mennesker har kurven et mere lineært forhold, særligt ved flerledsøvelser og imellem 40 og 100% af maksimal isometrisk kraft, hvor den ved hurtigere kontraktioner er mere kurvelineær.
Den excentriske del af kurven er en asymptote med en hurtig stigning i kraft i forhold til en relativt lille ændring i hastighed, hvorfra kraftstigningen stagnerer. Det er vist, at den maksimale excentriske kraft ligger mellem 20 og 60% højere end den maksimale isometriske kraft hos mænd, mens den i kvinder kun ligger 10% over maksimal isometrisk kraft. Større værdier er dog fundet ved elektrostimulering og efter træning, hvorfor en af grad central inhibering er mistænkt.
Hvordan vokser muskler?
Følgende afsnit er baseret på følgende reviews (9–11).
Helmuskelniveau
På helmuskelniveau kan en muskel blive større ved at øge dens længde og/eller tværsnitsareal. En øgning i længde er det, der kaldes longitudinel muskelvækst. Dette er især udtalt i takt med, at man går fra foster til voksen og som ens knogler bliver længere, så gør ens muskler også. I dyrestudier er longitudinel vækst på helkropsniveau også set, når dyr udsættes for ekstreme og langvarige stræk. Under normale omstændigheder i voksne forekommer muskelvækst via forlængelse af hele musklens længde dog i minimal grad. Her ses typisk en stigning i tværsnitsareal, som desuden sjældent hænger godt sammen med en stigning i muskelmasse og muskelvolumen. Svaret herpå skal findes i, at stigning i tværsnitsareal ikke finder sted ligeligt fordelt langs musklen, hvorfor nogle områder på musklen vil opleve store stigninger i tværsnit, mens andre vil have minimal forskel. Muskelmasse og -volumen vil derfor nærmere rapportere gennemsnittet af hele musklen. Dertil vil et tværsnit af en muskel kun fange en dimension af musklen, på trods af at den kan vokse i tre dimensioner.
Dette har relevans for kritisk læsning af forskning, da tværsnitmålinger muligvis over- eller undervurdere den reelle fremgang, alt efter hvilken del af musklen, tværsnitsarealet måles ved. Generelt er sammenhængen mellem målemetoder for muskelvækst lav, hvorfor forsigtighed bør være i højsædet, når man sammenligner studier.
Fascikelniveau
På fascikelniveau ved vi, at når vi først starter med at træne, ser vi en hurtig stigning i muskeltværsnit. Dette skyldes sandsynligvis ødemdannelse som følge af muskelskade. Langvarige stigninger i tværsnitsareal er dog primært grundet en stigning i antallet af myofibriller. Da myofibrillerne er musklens kraftproducerende enhed, vil en stigning i myofibriller resultere i både en stigning af hele musklens tværsnitsareal, men også dens maksimale kraftproduktion. Dette kan igen ske på to måder. Longitudinel og radial vækst af fasciklerne. Måske resulterer træning også i en stigning af antallet af fascikler, men dette er endnu ikke påvist.
Ud fra efterhånden rigtig meget litteratur på området er det ret tydeligt, at longitudinel vækst af fasciklerne forekommer efter styrketræning og forklarer en del af stigning i tværsnitareal efter træning. Radial vækst forekommer dog også, og især i studier hvor ingen øgning af fascikellængde forekommer vil en stigning i tværsnit, som følge af radial vækst, medføre en stigning i pennationsvinkel. Tilsammen forklarer disse sandsynligvis en stor del af stigningen i tværsnitsareal, og graden af hver afhænger nok af kontraktionstype og type af muskel (fusiform eller penat).
På mikroskopisk niveau afhænger en stigning i longitudinel muskelvækst af, om en fascikels muskelfibre løber langs hele fasciklens længde eller kun noget af længden. Hvis de løber langs hele fasciklens længde, vil longitudinel myofibervækst også resultere i longitudinel fascikelvækst. Løber muskelfibrene dog kun noget af fasciklens længde, så kan longitudinel fascikelvækst teoretisk set ske både ved longitudinel myofibervækst, men også via tilføjelse af ekstra myofibre i serie. Den sidstnævnte er dog endnu ikke påvist videnskabeligt.
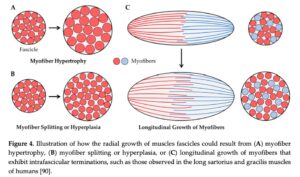
Radial vækst af fascikel kan ske på flere måder; en stigning i tværsnittet af de eksisterende myofibre (myofiberhypertrofi), en stigning i antallet af myofibre pr tværsnit (myofiber-splitting eller hyperplasi) eller longitudinel vækst af myofibre, der ikke løber langs hele fasciklens længde.
Myofiber hypertrofi er som sagt stigningen i den enkelt myofibers tværsnit og er den mest anerkendte og længst kendte bidragsyder til helmuskelvækst.
Myofiber splitting er, når en muskelfiber deler sig og bliver til flere muskelfibre langs dens længde. Mens det er blevet påvist, at dette forekommer, så er evidensen for at det forekommer, og i nævneværdig grad som følge af træning, ikke overbevisende. Så dette skal nok ikke betragtes som en primær bidragsyder til muskelvækst.
Hyperplasi er nydannelsen af muskelfibre og er overbevisende set gennem årene fra foster til voksen. Forekomsten af hyperplasi som følge af træning er dog meget kontroversiel med ingen longitudinel data i mennesker til støtte. Kun enkelte dyrestudier med ekstreme belastningsmetoder har observeret en stigning i antallet af fibre efter træning, mens andre har vist ingen. Hvis hyperplasi har en nævneværdig rolle i muskelvækst, kender vi den ikke endnu.
Myofiberniveau
Som gennemgået tidligere er der overbevisende litteratur, der beskriver, at longitudinel muskelvækst forekommer. Dette gælder også på myofiberniveau. Da myofibre og myofibriller består af lange rækker af sarkomere i serie, så vil longitudinel myofibervækst altså være et resultat af én af to ting. Enten en forlængelse af de enkelte sarkomere eller tilføjelsen af flere sarkomere i serie. Da en sarkomers optimale hvilelængde er relativt konstant hos en art og kun kan operere indenfor et lille spektrum af denne længde, vil det være rimeligt at antage, at en forlængelse af den enkelte sarkomer er højst usandsynlig. Tilføjelsen af sarkomere i serie er derimod godt understøttet. Det eneste, vi ikke ved med sikkerhed, er helt præcist, hvordan dette sker, og hvor i rækken de tilføjes. Nogle studier tyder på, at de tilføjes i enden af myofibrillen, mens andre tyder på, at de bliver indsat langs hele længden af myofibrillen.
Når det kommer til emnet om radial vækst, så er der først noget, vi skal have fastlagt. Det er udtrykket ’specifik spænding’. Specifik spænding er konceptet om, at den maksimale isometriske spænding, en myofiber kan producere, er direkte proportionel med antallet af kraftgenererende elementer, der arbejder parallelt med kraftproduktionens retning, og at antallet af kraftgenereende elementer er proportionelt med myofiberens tværsnitareal. Dette lyder måske mærkeligt og kompliceret, men det er vigtigt for at forstå, hvad den radiale vækst består af. Ses der en stigning i tværsnit og en tilsvarende stigning i maksimal isometrisk kraftproduktion, altså ingen ændring i specifik spænding, så er stigning i tværsnit sket som følge af en proportionel stigning i kraftgenererende elementer (myofibriller) og ikke-kraftgenerende elementer (sarkoplasma, mitokondrier osv). Er den specifikke stigning steget, så er stigningen kraftgenererende elementer steget mere end de ikke-kraftgenererende og vice versa. Størstedelen af litteraturen tyder på, at den specifikke spænding er uændret eller steget i hypertrofierede muskelfibre (6).
Sarkoplamatisk hypertrofi er som sagt en stigning i en myofibers eller muskels tværsnitareal med et fald i specifik spænding til følge. Dette skyldes som sagt en uproportionel stor stigning i ikke-kraftgenereende muskelelementer som for eksempel væske, mitokondrier, SR, glykogen osv. Nogle studier finder, at sarkoplasmatisk finder sted, mens andre ikke gør. Mange af disse studier er dog gamle, bruger få deltagere eller er tværsnitsstudier, hvorfor det er svært at sige noget specifikt om forekomsten heraf (11,21). Størstedelen af longitudinelle studier tyder dog på, at specifik spænding er vedligeholdt eller stiger efter træning (6), hvilket stiller spørgsmålstegn ved relevansen af sarkoplasmatisk hypertrofi. Ikke desto mindre har Roberts et al. (2020) fremlagt tre hypoteser for, hvorfor sarkoplasmatisk hypertrofi måtte finde sted: 1) et forbigående symptom på overtræning, altså træningsinduceret ødemdannelse, 2) en forbigående mekanisme for muskelfibervækst og/eller 3) et udtryk for, at en person har ramt sin øvre grænse for myofibrillær proteinopbygning. Med andre ord kan sarkoplasmatisk være et udtryk for muskelskadende træning eller et udtryk for, at muskelcellen udvider sin sarkoplasma, hvor nye myofibriller så kan placeres og opregulerer enzymer krævet for ATP-dannelse og ribosomal biogenese. Under alle omstændigheder er sarkoplasmatisk altså et forbigående fænomen, som enten vil resultere i en returnering til præ-træningsværdier eller vil resultere i en superkompensationseffekt. Hvilken der er tale om vides dog ikke endnu.
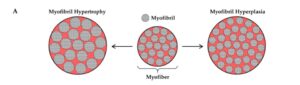
Udvidelsen af de kraftgenerende elemtenter er en stigning i en myofibers eller muskels tværsnitareal med en stigning eller ingen ændring i specifik spænding til følge. Dette skyldes en stigning i de kraftgenerende elementer, som er sarkomererne. I sarkomeren er afstanden mellem aktin og myosinfilamenterne stort set vedligeholdt, hvorfor en stigning i mængden af aktin og myosin vil resultere i en stigning i sarkomerens tværsnit. Det er ikke grundigt undersøgt, om en stigning i myofiberens tværsnit kommer som følge af hypertrofi eller hyperplasi af myofibrillerne, hvilket er overraskende, at man ikke ved nok om. Noget tyder dog på, at begge forekommer og i nogenlunde ens grad. Sammenhængen mellem myofibrillær hypertrofi og hyperplasi er baseret på en 40 gammel model af Dr. Goldspink om myofibril splitting. Denne model giver mening, men det skal siges, at den er dårligt understøttet. Teorien går som følger. 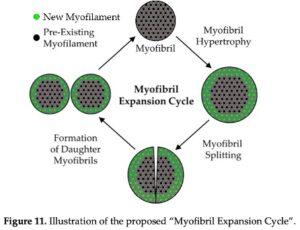 Når udvidelsen af kraftgenerende elementer starter, påbegyndes dét, Jorgenson et al. (2020) kalder ”the myofibril expansion cycle”, som først består af myofibrillær hypertrofi, hvorved nye myofilamenter (aktin og myosin) tilføjes langs perifærien af myofibrillen. Når den enkelte myofibril rammer dét, der kaldes ”critical size”, flækkes en Z-disk, hvorved myofibrillen deles til to mindre dattermyofibriller (myofibrillær hyperplasi), hvori hele processen kan starte forfra. Grunden til, at Z-disken skulle knække, er, at aktin-filamenterne tilsyneladende har et skævt træk, som forstørres, når hypertrofi opstår, hvorved Z-disken til sidst ikke længere kan holde til det store skæve træk. Igen, støtten for hypotesen er kun understøttet af enkelte studier, primært fordi vi ikke har haft teknologien til at undersøge den. Den har vi dog nu, og vi bliver sikkert klogere i fremtiden.
Når udvidelsen af kraftgenerende elementer starter, påbegyndes dét, Jorgenson et al. (2020) kalder ”the myofibril expansion cycle”, som først består af myofibrillær hypertrofi, hvorved nye myofilamenter (aktin og myosin) tilføjes langs perifærien af myofibrillen. Når den enkelte myofibril rammer dét, der kaldes ”critical size”, flækkes en Z-disk, hvorved myofibrillen deles til to mindre dattermyofibriller (myofibrillær hyperplasi), hvori hele processen kan starte forfra. Grunden til, at Z-disken skulle knække, er, at aktin-filamenterne tilsyneladende har et skævt træk, som forstørres, når hypertrofi opstår, hvorved Z-disken til sidst ikke længere kan holde til det store skæve træk. Igen, støtten for hypotesen er kun understøttet af enkelte studier, primært fordi vi ikke har haft teknologien til at undersøge den. Den har vi dog nu, og vi bliver sikkert klogere i fremtiden.
Hvorfor vokser muskler?
Følgende afsnit er baseret på følgende referencer (10,12,14,22).
Meget forsimplet så vokser muskler, når vi har en positiv proteinbalance i muskulaturen. Lidt ligesom energibalancen i forhold til vores kropsvægt. Proteinbalancen i vores krop består af mængden af proteinnedbrydning, også kaldet proteolyse, og proteinopbygningen, også kaldet proteinsyntesen. Når proteinsyntesen overstiger proteinnedbrydningen i musklen, står vi altså med en net større mængde proteinmasse.
Dette kan opnås ved en stigning i proteinsyntese, som opstår efter træning, men også efter indtag af tilstrækkelige mængder protein. Det kan dog også opnås gennem en sænkning af proteolysen. Dermed ikke sagt, at alt proteinnedbrydelse er negativt, da en vis grad af proteinnedbrydelse er vist at være essentielt for muskelvækst og muskelkvalitet.
I de to tidligere afsnit har vi gennemgået, hvordan musklen er opbygget, og hvordan den vokser. Nu skal vi gennemgå hvorfor. Det inkluderer, at vi skal definere, hvad der får musklen til at vokse (altså stimuli), og hvad der opfatter stimuli (sensoren).
Mekaniske stimuli
Hvad er mekaniske stimuli? En mekanisk stimulus er et udtryk for en ændring i musklens form eller kræfterne herpå. Dette kan være en sammentrækning af muskulaturen, som vil forkorte og trække i musklens strukturelle proteiner, også kaldet aktiv mekanisk spænding. Det kan være et stræk, også kaldet passiv mekanisk spænding, og det kan være en hævelse i muskelfiberen, som igen øger presset på cellens proteinstruktur. Mekaniske stimuli er nok den stimulus, vi har bedst evidens for at være en primær mekanisme, hvorigennem muskelvækst finder sted. Evidensen er dog primært indirekte og vist igennem tre slags studier: 1) muskelsvind/atrofi som følge af immobilisering, 2) ekstrem muskelvækst som følge af muskelablation og 3) muskelvækst som følge af styrketræning. Når mekaniske kræfter er udeblivende, så har andre stimuli typisk en lille effekt på muskelvækst.
Aktiv mekanisk spænding
Når musklen trækker sig sammen, dannes der fra sarkomererne et træk på sarkolemma, altså en øget spænding. Denne spænding er det, vi kalder mekanisk spænding. Jo hårdere musklen trækker sig sammen, ved at aktivere alle sine sarkomerer og ved at have så stort overlap mellem aktin og myosin som muligt, jo højere aktiv mekanisk spænding. Altså er aktiv mekanisk spænding afhængig af rekrutteringen af motoriske enheder, længdespændingsforholdet og krafthastighedskurven.
Præcist hvordan mekanisk spænding opfattes (hvilke sensorer der aktiveres) og medfører muskelvækst er ikke komplet afklaret, men det tænkes, at denne spænding opfattes i en kategori af proteiner kaldet mekanosensorer, hvor særligt costamerene og filamin-C tænkes at være de primære. Disse proteinkomplekser oversætter dette mekaniske input til et kemisk signal. Denne proces kaldes mekanotransduktion.
Costamererne fungerer ligesom det, der kaldes en fokal adhæsion, hvilket er en stor molekylær proteinsamling, hvorigennem mekaniske kræfter og reguleringssignaler overføres mellem en celle og den ekstracellulære matrix. Den overfører altså kræfter fra sarkomeren til andre sarkomerer samt den ekstracellulære matrix og omvendt. I costamererne findes der et stort antal proteiner, som står for overførslen af signaler mellem indersiden og ydersiden af sarkomeren. Selvom man endnu ikke ved helt specifikt, hvordan det sker, så ser mange af disse proteiner ud til at kunne direkte eller indirekte påvirke mTOR og derved proteinsyntesen som følge af en mekanisk stimulus.
Filamin-C hæfter på Z-disken, og aktin tænkes også at være en primær mekanosensor. Da filamin-C deformeres ved omkring 5-20pN, og et myosinhoved producerer omkring 6pN, tænkes det, at tilstrækkelige tværbroer vil være i stand til at deformere det. Dette er interessant, da filamin-C er associeret til androgen-receptorer, som påvirker muskelstørrelse, og proteinet Bag3, som tænkes at opfatte den mekaniske spænding i filamin-C. Igen ved vi ikke helt, hvordan dette medfører muskelvækst, men Bag3 er forbundet med flere signalveje, der regulerer både mTOR- og Hippo-signalering samt autofagi.
Cellehævelse
Cellehævelse, også kaldt pumpet, er fundet at øge muskelcellens glutaminoptag med 71% i isolerede rottemyofibre i et hypoosmotisk kulturmedie. En proces, som er fundet at være afhængig af costamer-associerede proteiner. Den skal dog siges, at selvom hævelse af muskler er fundet som følge af træning, så er hævelse af selve muskelfiberen endnu ikke påvist, hvorfor sikkerhed omkring pumpet som en mekanisk stimulus stadig må siges at være usikkert.
Passiv
Titin ligger som sagt parallelt med myosin og aktin. Det betyder, at når aktin og myosin binder, og musklen trækker sig sammen, vil titin opleve en mindre grad af spænding, hvorfor titin sandsynligvis ikke er en mekanosensor for aktiv muskelkontraktion. Ved længere muskellængder udstrækkes titin dog, hvorved dens kinase på M-båndet aktiveres, hvilket muligvis medfører nogle signalveje, der fører til muskelvækst. Der er endnu ikke fundet nogen direkte forbindelse mellem titin og mTOR, men titin er forbundet til proteinbalancen gennem Murf 1/2 og autofagi-signaleringen.
Selvom vi stadig er i de spæde stadier af forskningen på titin som en mekanosensor, så har flere fundet en sammenhæng mellem passiv spænding, titin og muskelvækst, særligt longitudinel muskelvækst (2,20). Det er dog vigtigt at anerkende, at passiv spænding i mange muskler ikke kan opnås indenfor normale fysiologiske bevægeudslag, hvilket kan være en del af forklaringen på, hvorfor større ROM ikke konsekvent er bedre for vækst i alle muskelgrupper.
Da cellekernen desuden er forbundet til sarkolemma gennem forskellige filamenter, vil den også opleve deformation ved mekaniske stimuli såsom kontraktion, stræk eller hævelse, hvilket er vist at øge aktivering af diverse signalveje, som er associeret til proteinsyntese. Indtil videre er dette dog kun observeret for stræk.
Metabolisk stress (7,22)
Som nævnt er mekaniske kræfter nok den primære faktor for muskelvækst, men noget tyder på, at metabolisk stress også kan være relevant. For eksempel er det vist, at immobiliserede muskler atrofierer mindre med intermitterende okklusion end uden. Metabolisk stress er et udtryk for ændringen i energimetabolisme og ophobningen af diverse affaldsstoffer som følge af aktivt muskelarbejde og derved et fald i pH. Lige nu florerer to primære hypoteser omkring metabolisk stress og muskelvækst: 1) at metabolisk stress i sig selv medfører øget anabolsk signalering, 2) at metabolisk stress øger udtrætningen af muskelfibren, hvilket tvinger kroppen til at øge rekrutteringen af motoriske enheder, hvilket medfører øget aktiv mekanisk spænding. Altså at metabolisk stress ikke er en primær hypertrofisk faktor, men at den blot øger den mekaniske spænding og er et resultat af muskelkontraktion.
En af de ting, der taler imod metabolisk stress, er, at metabolisk stress er typisk højere under omstændigheder, der er suboptimale for hypertrofi (failure sæt ved 25% af 1RM og løb) end 10RM sæt. Dertil kender vi stadig ikke nogen træningsmetoder, der er effektive til at resultere i muskelvækst, som har høj grad af metabolisk stress uden en høj mekanisk spænding. Faktisk er mange af de træningsformer, der har høj metabolisk stress, typisk associeret med et mindre hypertrofisk respons, som for eksempel konditionstræning. Dette mindre respons er sandsynligvis pga. opreguleringen af proteinet AMPK, som er hæmmende for mTOR, det primære protein der stimulerer proteinsyntesen.
Hvis metabolisk stress skulle være en stimulus for vækst, hvad skyldes det så? Laktat, også kendt som mælkesyre, er nok den bedst undersøgte metabolit og er da også vist at påvirke nogle anabolske signalveje (19), men alt evidens er indirekte, in vitro og typisk involverende doser af laktat, der ikke forekommer efter træning. Andre mulige metabolitter kunne være alpha-ketoglutarat, phosphatidic acid, lysophophatidic acid samt GAPDH. Fælles for dem alle er dog, at de in vivo endnu ikke har vist at gøre en forskel.
Muskelskade (3–5,22)
Den gamle model for muskelvækst hedder, at når vi træner, så river vi muskelfibrene fra hinanden, hvorefter de vokser sig større og stærkere. Dette er den basale teori omkring muskelskade. Det, der taler for teorien, er, at brugen af non-steroidal anti inflammatory drugs (NSAIDs) og antioxidant tilskud er vist at mindske tilpasninger til træning, så noget kunne tyde på, at frie radikaler og inflammation har en rolle at spille i det hypertrofiske respons. Inflammation og frie radikaler er dog også forbundet med mange andre tilstande, som ikke medfører muskelvækst.
Der er også mekanistisk evidens, der tyder på, at muskelskade medfører muskelvækst og større aktivering af satellitceller end ikke-muskelskadende træning, hvilket muligvis er nødvendigt for langvarig muskelvækst. Det er dog ikke sikkert, at denne ekstra aktivering af satellitceller bliver brugt til proteinsyntese, men måske nærmere til muskelreparation.
Problemet med teorien om, at muskelskade er en hypertrofi stimulus, er dog flerfoldigt. Det er nemlig svært at sammenligne protokoller, der medfører mere eller mindre muskelskade, uden at introducere flere confounders. For eksempel er træning med større ROM associeret med mere muskelskade, men det vil også medføre større passiv spænding og er vist i nogle muskler at medføre mere vækst. Det samme gør sig også gældende for excentrisk kontra koncentrisk træning. Forskellene mellem protokoller findes ikke kun i graden af muskelskade, da flere andre mekanismer påvirkes. Dertil har vi også flere protokoller som involverer mere muskelskade uden at give muskelvækst, som for eksempel ekstremt lange løbedistancer, men dette er igen sløret af en opregulering af AMPK, som sænker mTOR, hvorfor det er svært at vide, hvad betydningen af muskelskade helt præcist er. Til sidst har vi også studier der viser, at når vi starter med at træne, hvor muskelskaden er størst, så oplever musklen store stigninger i tværsnit og proteinsyntesen (4,5). Dette er jo ekstremt lovende for teorien om muskelskade. Problemet er blot, at denne stigning i muskeltværsnit forsvinder efter nogle uger, ligesom proteinsyntesestigningen ikke er forbundet med muskelvækst før efter 3 ugers træning. Det tyder altså på, at denne stigning i muskeltværsnit var en inflammatorisk hævelse, og at proteinsyntesen primært stod for reparation af skadet væv fremfor opbygning af mere.
Evidensen for en sammenhæng mellem muskelskade og muskelvækst er altså primært indirekte og langt fra overbevisende.
Opsummering
Muskler har en relativt simpel opbygning, hvor vi på det mindste plan har sarkomeren, musklens kraftproducerende element, som er arrangeret i forlængelse af og parallelt til hinanden inde i muskelfiberen. Disse muskelfibre er samlet i bundter af forskellige størrelse, hvert adskilt af bindevævslag, for til sidst at fremstå som de muskler, vi ser til dagligt og ønsker skal blive større.
Inde i sarkomeren har vi tre proteiner, som er af særlig relevans, nemlig myofilamenterne aktin, myosin og titin, som sammen står for at skabe spænding over musklen igennem tværbrosdannelse, men også viklingen af titin omkring aktin. Da det er disse proteiner, der er den primære bestanddel af musklernes proteinvæv, og da de står for musklens kraftproduktion, så er det dem, vi ønsker at få flere af, når vi træner.
Dette sker på to måder, enten gennem longitudinel vækst, hvorved ekstra sarkomerer tilføjes i forlængelse til den eksisterende kæde af sarkomerer, eller gennem radial vækst, hvor antallet af sarkomerer i parallel øges. Dette sker sandsynligvis ved, at antallet af myofilamenter i den enkelte sarkomer øges. Når sarkomeren har vokset tilstrækkeligt, sprænger Z-disken, hvorved den deles i to, og processen kan starte forfra. Når dette opnås i tilstrækkeligt omfang, vil øgningen manifestere sig på et højere og højere niveau i det at flere sarkomerer over tid vil resultere i større og/eller længere muskelfibre, som over tid kan ses på fascikel- og til sidst helmuskelniveau.
Men hvad får dette til at ske? De tre primære mekanismer, der foreslås at stå for muskelvækst, er mekanisk spænding, metabolisk stress og muskelskade. Litteraturen på de to sidstnævnte er dog ikke overbevisende, ligesom det ikke er muligt at få en muskel til at vokse med meget metabolisk stress eller muskelskade, uden at den mekaniske spænding er høj. Mekanisk spænding er altså sandsynligvis den primære årsag bag muskelvækst. Denne kan så videre inddeles i aktiv og passiv spænding. Den aktive spænding er et andet ord for antallet af tværbroer mellem aktin og myosin, der dannes, og vil derfor være afhængig af muskellængde, kontraktionshastighed og rekrutteringen af motoriske enheder. Hvordan denne spænding medfører en stigning i proteinsyntese er endnu ikke komplet afklaret, men deformering af costamerene og filamin-C, tænkes at være sensoren. Den passive spænding derimod ser ud til at være afhængig af spændingen i titin, som primært er drevet af bevægeudslag.
Referencer
- Alcazar, J, Csapo, R, Ara, I, and Alegre, LM. On the Shape of the Force-Velocity Relationship in Skeletal Muscles: The Linear, the Hyperbolic, and the Double-Hyperbolic. Front Physiol 10, 2019.
- Brynnel, A, Hernandez, Y, Kiss, B, Lindqvist, J, Adler, M, Kolb, J, et al. Downsizing the molecular spring of the giant protein titin reveals that skeletal muscle titin determines passive stiffness and drives longitudinal hypertrophy. Elife 7, 2018.
- Damas, F, Libardi, CA, Ugrinowitsch, C, Vechin, FC, Lixandrão, ME, Snijders, T, et al. Early- and later-phases satellite cell responses and myonuclear content with resistance training in young men. PLoS ONE13: e0191039, 2018.
- Damas, F, Phillips, SM, Libardi, CA, Vechin, FC, Lixandrao, ME, Jannig, PR, et al. Resistance training-induced changes in integrated myofibrillar protein synthesis are related to hypertrophy only after attenuation of muscle damage. The Journal of Physiology 594: 5209, 2016.
- Damas, F, Phillips, SM, Lixandrao, ME, Vechin, FC, Libardi, CA, and Roschel, H. Early resistance training-induced increases in muscle cross-sectional area are concomitant with edema-induced muscle swelling. Eur J Appl Physiol 116, 2016.
- Dankel, SJ, Kang, M, Abe, T, and Loenneke, JP. Resistance training induced changes in strength and specific force at the fiber and whole muscle level: a meta-analysis. Eur J Appl Physiol 119: 265–278, 2019.
- Dankel, SJ, Mattocks, KT, Jessee, MB, Buckner, SL, Mouser, JG, and Loenneke, JP. Do metabolites that are produced during resistance exercise enhance muscle hypertrophy? Eur J Appl Physiol , 2017.
- Frontera, WR and Ochala, J. Skeletal muscle: a brief review of structure and function. Calcif Tissue Int96: 183–195, 2015.
- Haun, CT, Vann, CG, Roberts, BM, Vigotsky, AD, Schoenfeld, BJ, and Roberts, MD. A Critical Evaluation of the Biological Construct Skeletal Muscle Hypertrophy: Size Matters but So Does the Measurement. Front Physiol 10, 2019.
- Henderson, CA, Gomez, CG, Novak, SM, Mi-Mi, L, and Gregorio, CC. Overview of the Muscle Cytoskeleton. Compr Physiol 7: 891–944, 2017.
- Jorgenson, KW, Phillips, SM, and Hornberger, TA. Identifying the Structural Adaptations that Drive the Mechanical Load-Induced Growth of Skeletal Muscle: A Scoping Review. Cells 9, 2020.
- Krüger, M and Kötter, S. Titin, a Central Mediator for Hypertrophic Signaling, Exercise-Induced Mechanosignaling and Skeletal Muscle Remodeling. Front Physiol 7: 76, 2016.
- Lieber, RL. Skeletal muscle adaptability. I: Review of basic properties. Dev Med Child Neurol 28: 390–397, 1986.
- Marcotte, GR, West, DWD, and Baar, K. The Molecular Basis for Load-Induced Skeletal Muscle Hypertrophy. Calcif Tissue Int 96: 196–210, 2015.
- Monroy, JA, Powers, KL, Gilmore, LA, Uyeno, TA, Lindstedt, SL, and Nishikawa, KC. What is the role of titin in active muscle? Exerc Sport Sci Rev 40: 73–78, 2012.
- Nishikawa, K. Eccentric contraction: unraveling mechanisms of force enhancement and energy conservation. J Exp Biol 219: 189–196, 2016.
- Nishikawa, K. Titin: A Tunable Spring in Active Muscle. Physiology (Bethesda) 35: 209–217, 2020.
- Nishikawa, KC, Monroy, JA, Uyeno, TE, Yeo, SH, Pai, DK, and Lindstedt, SL. Is titin a ‘winding filament’? A new twist on muscle contraction. Proc Biol Sci 279: 981–990, 2012.
- Ohno, Y, Oyama, A, Kaneko, H, Egawa, T, Yokoyama, S, Sugiura, T, et al. Lactate increases myotube diameter via activation of MEK/ERK pathway in C2C12 cells. Acta Physiol (Oxf) 223: e13042, 2018.
- Pijl, R van der, Strom, J, Conijn, S, Lindqvist, J, Labeit, S, Granzier, H, et al. Titin-based mechanosensing modulates muscle hypertrophy. Journal of Cachexia, Sarcopenia and Muscle 9: 947–961, 2018.
- Roberts, MD, Haun, CT, Vann, CG, Osburn, SC, and Young, KC. Sarcoplasmic Hypertrophy in Skeletal Muscle: A Scientific “Unicorn” or Resistance Training Adaptation? Front Physiol 11: 816, 2020.
- Wackerhage, H, Schoenfeld, BJ, Hamilton, DL, Lehti, M, and Hulmi, JJ. Stimuli and sensors that initiate skeletal muscle hypertrophy following resistance exercise. J Appl Physiol 126: 30–43, 2019.


